INVESTIGACIÓN
Primera separación química de las dos formas del agua
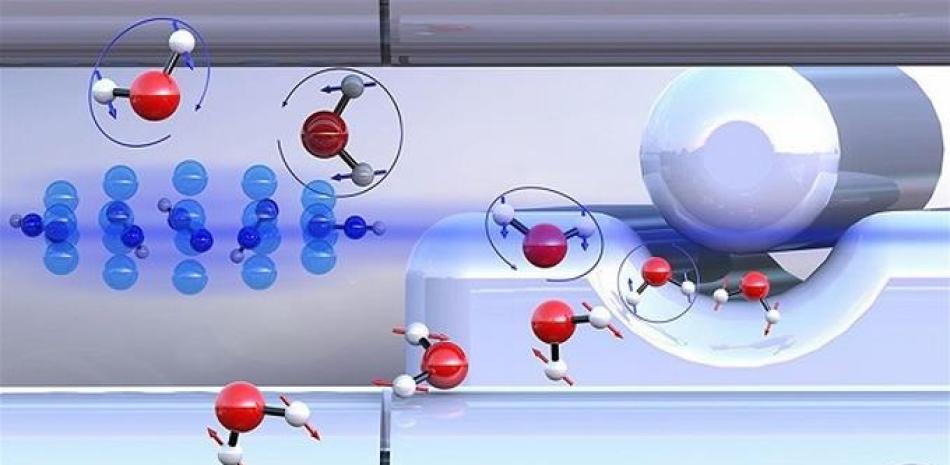
Por primera vez, en la Universidad de Basilea se ha logrado separar las dos formas en que se presentan las moléculas de agua, para mostrar que pueden exhibir diferentes reactividades químicas.
Desde una perspectiva química, el agua es una molécula en la que un solo átomo de oxígeno está vinculado a dos átomos de hidrógeno. Es menos conocido que el agua existe en dos formas diferentes (isómeros) a nivel molecular.
La diferencia radica en la orientación relativa de los espines nucleares de los dos átomos de hidrógeno. Dependiendo de si los giros están alineados en la misma dirección o en la dirección opuesta, uno se refiere a orto o a para-agua.
El grupo de investigación encabezado por el profesor Stefan Willitsch del Departamento de Química de la Universidad de Basilea ha investigado cómo las dos formas de agua difieren en términos de su reactividad química: su capacidad de experimentar una reacción química. Ambos isómeros tienen propiedades físicas casi idénticas, lo que hace que su separación sea especialmente desafiante.
Esta separación fue posible gracias a un método basado en campos eléctricos desarrollado por el profesor Jochen Küpper del centro de la Universidad de Hamburgo para la ciencia del láser de electrón libre. Usando este enfoque, los investigadores pudieron iniciar reacciones controladas entre los isómeros de agua "pre-clasificados" y los iones de diazenilo ultrafríos ("nitrógeno protonado") retenidos en una trampa. Durante este proceso, un ion diazenilo transfiere su protón a una molécula de agua. Esta reacción también se observa en la química del espacio interestelar.
Se demostró que la para-agua reacciona aproximadamente un 25% más rápido que la orto-agua. Este efecto puede explicarse en términos del giro nuclear que también influye en la rotación de las moléculas de agua. Como resultado, diferentes fuerzas atractivas actúan entre los compañeros de reacción. La para-agua es capaz de atraer a su compañero de reacción con más fuerza que la orto-forma, lo que conduce a una mayor reactividad química. Las simulaciones por ordenador confirmaron estos hallazgos experimentales.
En sus experimentos, los investigadores trabajaron con moléculas a muy bajas temperaturas cerca del punto cero absoluto (alrededor de -273 ° C). Estas son las condiciones ideales para preparar con precisión estados cuánticos individuales y definir el contenido de energía de las moléculas, y para provocar una reacción controlada entre ellas.
Willitsch explica el enfoque experimental: "Mientras mejor se puedan controlar los estados de las moléculas involucradas en una reacción química, mejor se podrán investigar y comprender los mecanismos subyacentes y la dinámica de una reacción".