Estados Unidos autoriza la primera prueba para autodiagnóstico de COVID-19 desde casa
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) ha emitido una autorización de uso de emergencia (EUA, por sus siglas en inglés) para la primera prueba de COVID-19 de autodiagnóstico en casa y que proporciona resultados en unos 30 minutos.
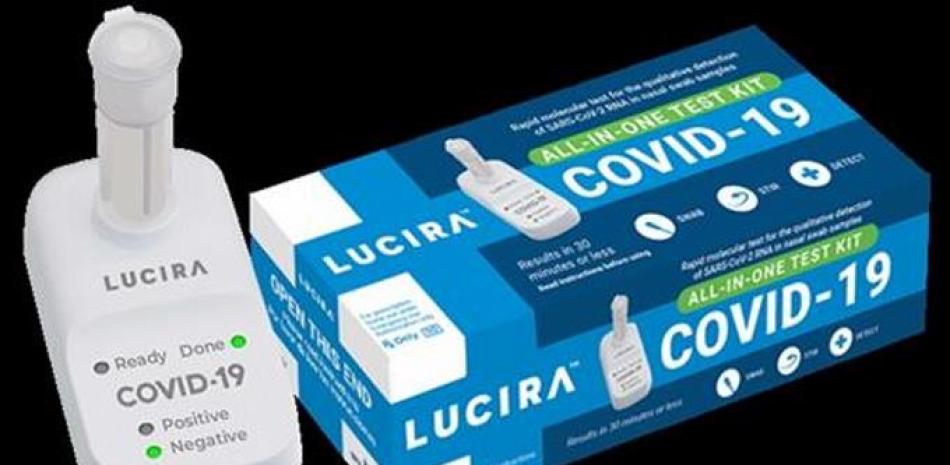
El kit, de la compañía Lucira, es una prueba molecular de un solo uso que funciona de la siguiente manera: la persona se toma la muestra con hisopo nasal y la lectura del resultado es un led luminoso en el dispositivo de lectura, que indica positivo o negativo en COVID-19.
La prueba 'Lucira COVID-19 All-In-One Test Kit' ha sido autorizada para su uso en el hogar con muestras de hisopado nasal en personas de 14 años o más que son sospechosas de tener COVID-19 por su médico. También está autorizado para su uso en consultorios médicos, hospitales, centros de atención urgente y Urgencias para todas las edades, pero las muestras deben ser recogidas por un médico cuando la prueba se utiliza para examinar a los individuos menores de 14 años. En la actualidad, la prueba está autorizada únicamente para su uso con receta médica.
La prueba funciona haciendo girar el hisopo de la muestra recogida en un vial que luego se coloca en la unidad de prueba. En 30 minutos o menos, los resultados pueden leerse directamente en la pantalla luminosa de la unidad de prueba que muestra si una persona es positiva o negativa para el virus del SARS-CoV-2.
Los médicos que prescriben la prueba están obligados a comunicar todos los resultados de las pruebas que reciben de las personas que las utilizan a sus autoridades de salud pública competentes, de conformidad con los requisitos locales, estatales y federales. Lucira Health, el fabricante de la prueba, también ha elaborado un etiquetado de la caja, instrucciones de referencia rápida e instrucciones para los proveedores de atención de la salud para ayudar a la presentación de informes.
Según ha informado la compañía, en un estudio de pruebas en el que se comparó su prueba con una de alta sensibilidad autorizada por la FDA, su test logró un 94 por ciento de acuerdo porcentual positivo (PPA) y un 98 por ciento de acuerdo porcentual negativo (NPA). Excluyendo las muestras con niveles muy bajos de virus que posiblemente ya no reflejaban una infección activa1, Lucira logró un acuerdo porcentual positivo del cien por cien.
"La FDA continúa demostrando su velocidad sin precedentes en respuesta a la pandemia. Si bien se han autorizado las pruebas de diagnóstico de COVID-19 para su recolección en el hogar, ésta es la primera que puede ser totalmente autoadministrada y proporcionar resultados en el hogar. Esta nueva opción de pruebas es un importante avance diagnóstico para abordar la pandemia y reducir